青年科学工作者论坛2008年第3期
调查研究
孕晚期母亲不同铁状态下胎盘Ferroportin1的表达
李燕琴 颜虹 ,* 白斌1,张倩2
西安交通大学医学院公共卫生系,710061
摘 要 目的:为进一步理解FP1在人胎盘铁输出中的作用,对母亲不同铁营养状态下胎盘ferroportin1 (FP1)的蛋白表达、定位及其mRNA表达的变化进行了测定。方法:临床选择不同铁营养状态的孕妇,收集分娩时的胎盘。采用免疫组织化学方法测定FP1蛋白的定位,Western Blot测定蛋白表达量的变化,mRNA表达测定采用实时定量RT-PCR。结果:结果显示FP1蛋白主要表达在人足月胎盘的合体滋养细胞(STB)胞浆;母亲不同铁营养状态下胎盘FP1蛋白和mRNA 的表达均无明显变化。结论:研究结果提示胎盘FP1的表达可能有多种调节机制。除了FP1外,可能还有其它的因子直接或间接参与胎盘的铁输出。
关键词:胎盘 铁转运 ferroportin1
中图分类号: 文献标识码:
Expression of Ferroportin1Within Human Term Placentas from Different Maternal Iron Status
Li Yan-qin1,Yan Hong1,*,Bai Bin2,Zhang Qian3
1 Faculty of Public Health, Xi'an Jiaotong University School of Medicine, Xi'an, Shaanxi Province 710061
2 The First Affiliated Hospital of the School of Medicine, Xi'an Jiaotong University, Xi'an, Shaanxi Province 710061
3 The 630 Hospital of Yan-liang, Xi'an, Shaanxi Province 710089
Abstract: Objective To better understand the role of ferroportin1 (FP1) in human placental iron efflux, the protein and mRNA expression of FP1 within human term placenta were examined.
Methods Forty human term placentas were collected from pregnant women with different degree of maternal iron deficiency. The localization of FP1 protein within the placenta was showed by immunohistochemical staining. The protein and mRNA expression of FP1 were assessed by means of Western Blot and real-time quantitative RT-PCR. Results The study showed that there is no significant change for FP1 expression at both protein and mRNA levels among different maternal iron status. FP1 staining was detected in the placental syncytiotrophoblast (STB) cells and distributed predominantly in the cytoplasm. Conclusion Both protein and mRNA expression of FP1 within human term placentas showed no significant change with different degree of maternal iron status. It indicated that the expression of FP1 protein in human placenta was probably regulated by several mechanisms. And there might be other proteins involved in the placental iron efflux directly or indirectly besides FP1.
Key words: placenta; iron transfer; ferroportin1
孕育中的胎儿也需要大量的铁来满足自身生长发育的需要,胎儿所需的铁完全来自母体供给。母体的铁向胎儿的转运是通过胎盘介导的单向(从母体到胎儿)、逆浓度梯度(主动的)的转运过程,但胎盘铁输出的分子机制至今尚未阐明。作为至今为止发现的唯一一个直接参与细胞铁输出的蛋白[1],2000年发现的跨膜铁输出蛋白Ferroportin1 (FP1,MTP1,IREG1)[2, 3]为进一步研究胎盘铁输出的分子机制提供了重要的线索。初步研究表明,FP1可能在铁从母体到胎儿的转运中起着重要作用,但尚无明确的结论。为进一步理解FP1在胎盘铁输出中的作用,本研究同时测定了母亲不同铁营养状况下胎盘FP1蛋白表达、定位及其mRNA表达的变化。
2 材料与方法
2.1 对象
在西安交通大学医学院第一附属医院分娩的基本健康的孕妇,尤其注意排除合并母亲心血管疾病、代谢性疾病、血液疾病、高血压、糖尿病等可能影响胎盘铁转运的孕妇,排除慢性病贫血和溶血性贫血,将患有不同程度贫血的孕妇顺序纳入。本研究得到西安交通大学医学伦理委员会的同意,分娩前取得了孕妇的知情同意。共纳入孕妇40名。
分娩前采孕妇的静脉血,用自动血液生化检测仪进行血常规检测,获得血红蛋白(Hb)等血液学指标。孕晚期贫血的诊断采用WHO推荐的标准,即Hb<110g/L而且红细胞压积 (Hct) < 33.0%。根据母亲Hb水平将研究对象分为3组:非贫血组(Hb≥110g/L),轻度贫血组(90 g/L≤Hb <110 g/L) 和中度贫血组(Hb <90 g/L)。
2.2 胎盘组织收集
胎盘娩出后快速剪取小块的胎盘组织,所有接触胎盘的材料均预先经灭RNA酶处理。首先取多个小块绒毛组织用DEPC水快速冲洗血液,然后放入无RNA酶的EP管中迅速投入液氮里,后放入-80°C冰箱保存备用。另切取从母面到胎儿面的全层胎盘组织(约1×1×2cm3)简单用无菌生理盐水冲洗血液后放入4%多聚甲醛中固定。
2.3 免疫组织化学染色
固定在4%多聚甲醛的胎盘组织经一系列梯度酒精脱水,二甲苯以及石蜡包埋等标准步骤后,切成5 µm厚的切片,在水浴锅中展开后捞到多聚赖氨酸处理的载波片上。60°C 干燥箱中放60 min后放到37°C 烤箱中待用。梯度二甲苯和酒精脱蜡水化后用0.01 mol/L 柠檬酸缓冲液(pH 6.0)进行抗原修复15 min,然后凉至室温。3% H2O2 10 min阻断内源性过氧化物酶活性。0.5% TritonX-100 打孔10 min。用兔抗鼠MTP1抗体(Alpha Diagnostic International, ADI, U.S.A)进行FP1抗原的检测(1:50稀释),一抗于4°C孵育过夜。阴性对照用PBS代替一抗。 二抗采用PV6001( PowerVisionTM Two-Step 组化试剂,北京中杉金桥生物技术公司) 以排除胎盘组织对于生物素的非特异性反应。显色采用DAB,室温3~15 min,镜下控制显色时间。苏木素复染后脱水、透明、封片烤干并照相。
2.4 Western Blot
称取小块胎盘组织(~300mg)于完全的RIPA裂解液中,用玻璃匀浆器匀浆,同时加入蛋白酶抑制剂PMSF(1mmol/L)。然后于4°C 1,000×g 离心5 min。收集上清并转入EP管4°C 12,000×g 离心10 min。再收集上清并分装储存于-80°C冰箱待用。总蛋白定量采用BCA蛋白定量试剂盒(Pierce Endogen, Rockford, IL)。定量后计算50μg总蛋白的液体,用灭菌的去离子水补足体积至12 ml,并与3 ml 5×上样缓冲液混合(4:1),混合物被煮沸5 min后凉至室温。上样量15 μl/孔,10% SDS-聚丙烯酰胺凝胶电泳1-2 h,转膜3 h。 用0.1% PBST 配置的5%脱脂奶粉封闭1 h。 然后用兔抗鼠MTP1抗体一抗4°C孵育过夜(1:200稀释)。β-actin (1:500,北京博奥森) 作为内参。二抗采用山羊抗兔二抗(Pierce Biotechnology, Inc. U.S.A) ,1:500稀释,室温孵育2 h。DAB显色,用Gel-Pro Analyzer软件进行图像扫描和分析。
2.5 实时定量PCR
2.5.1 RNA提取
胎盘组织总RNA的提取采用TRIzol试剂(Invitrogen Inc., Canada) ,按照说明书步骤提取。50-100 mg的胎盘组织加入1ml TRIzol,用灭酶的玻璃匀浆器匀浆。每1 ml TRIzol加入0.2 ml氯仿,离心后取上层无色水样层至另一EP管,然后按0.5 ml异丙醇/1 ml TRIzol比例加入异丙醇。离心后以75%乙醇
(1 ml/1 ml TRIzol)洗涤RNA沉淀。最后用DEPC水(20~40 μl )溶解沉淀。通过RNA定量( NanoDrop ND-1000) 计算A值( 260:280 nm)和浓度,1% 琼脂糖电泳检测提取的RNA的纯度。
2.5.2 cDNA合成 反转录试剂盒采用RevertAidTM First Strand cDNA Synthesis Kit ( Fermentas)。在冰上给总RNA(500ng)中加入随机引物,70°C变性5 min。然后加入5×反应缓冲液,RiboLockTM Ribonuclease 抑制剂以及10nmol/L dNTP Mix,混合物于25°C孵育5 min。最后加入RevertAid MMLV-反转录酶,25°C孵育10 min,然后42°C孵育60 min,最后于70°C孵育10 min终止反应。
2.5.3 实时定量PCR 实时定量PCR用SYBR Green I 荧光嵌合法,ABI Prism 7000 Sequence Detector (PE Applied Biosystems, Courtaboeuf, France)。引物序列如下:FP1: 5´-GAGCAGCAGCAGCGATAG-3´(上游)和5´-AGAATGACCAAGGTAGAGAAGG-3´(下游);β-actin: 5´-GCGTAGCATTAAGGAGAAG-3´(上游)和 5´-GAAGGAAGGCTGGAAGAG-3´(下游)。
PCR总反应体积25 μl,每个样品重复3次。PCR反应混合物包括12.5 μl 的SYBR Green Realtime PCR Master Mix (TOYOBO, Co. Ltd, Osaka, Japan),1.0 μl上游和下游引物(10 umol/L),8.5 μl 的H2O 和2.0 μl 的cDNA。PCR循环:95°C变性60 s, 95°C (15s) 40个循环,55°C退火15s,然后72°C (45s)。PCR扩增实时记录的溶解曲线分析和PCR扩增产物的2%琼脂糖凝胶电泳用于辨别引物二聚体和非特异性扩增。
每个样品的扩增的Ct值以β-actin的作为参照。Ct 值是指每个反应管内的荧光信号达到阈值时所经历的循环数。没有干预的样品作为参考样品。相对定量采用相应的软件( Relative Expression Software Tool – 384, Dr. Michael Pfaffl)进行分析(计算方法基于2-△△Ct 值)。
2.6 统计分析
统计分析用SPSS软件,全部数据表达以 ±s表示,三组对象(非贫血组、轻度贫血组、中度贫血组)之间比较用单因素方差分析,如果需要两组之间比较则采用LSD检验。P<0.05认为有统计学显著性。
3 结果
3.1 母亲的临床特征
40名研究对象中18名没有贫血,17名有轻度贫血,5名中度贫血。母亲平均年龄为(29.2 ± 4.0)岁(23~39岁)。平均孕龄为(39.1 ± 1.5)周(37~42周)。 三组对象母亲的年龄和孕龄没有显著差别。
3.2 FP1蛋白在人足月胎盘的定位
FP1染色主要在STB细胞,且主要分布于胞浆,胎盘其它细胞几乎不表达(图1)。三组的染色定位一致,染色强度没有明显差异。
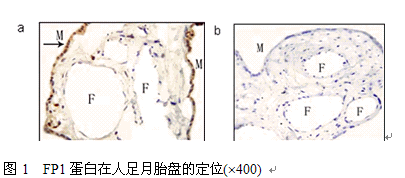
图1 FP1蛋白在人足月胎盘的定位(´400)
(a) FP1蛋白的阳性表达 (b) 阴性对照。M (母体面); F (胎儿面);→ (指向阳性染色部位)。
Figure 1. The localization of FP1 protein expression in human term placenta (´400). (A) FP1 protein positive expression. (B) Negative control image showed no positive staining. M (maternal side); F (fetal side); → (point to positive staining)
3.3 不同母亲铁状态下胎盘FP1蛋白表达
Western Blot 显色,FP1蛋白条带大约在~62 kDa位置;β-actin条带约在~42kDa位置。虽然三组的FP1蛋白表达呈逐渐降低的趋势,但没有明显的统计学差异。见图2。
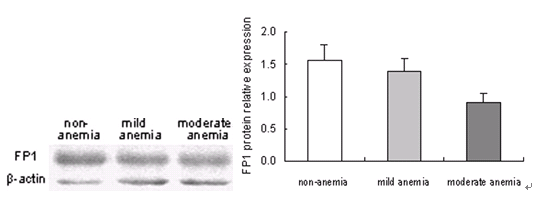
图2 不同母亲铁状态下胎盘FP1蛋白表达的变化
Figure 2. Change of FP1 protein expression in human term placenta with different maternal iron status
3.4 不同母亲铁状态下胎盘FP1 mRNA表达
实时定量PCR扩增曲线平滑,溶解曲线呈单峰型。扩增产物电泳显示单一条带。说明没有引物二聚体和非特异性扩增。统计分析结果显示,三组之间FP1的mRNA表达也没有明显的统计学差异。而且mRNA表达和蛋白表达并不一致。见图3。
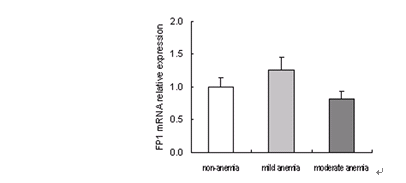
图3 不同母亲铁状态下胎盘FP1 mRNA表达的变化
Figure 3. Change of FP1 mRNA expression in human term placenta with different maternal iron status
4 讨论
有关胎盘铁输出的分子机制,人们一直在探索。早认为可能是以低分子量铁通过基膜进入胎儿血液循环的[4]。后来发现STB的胎儿面和母体面均有TfR1的分布,而且二者都能结合并内化Tf[5]。因此对胎儿面TfR1可能参与铁从胎盘到胎儿血液循环的跨基底膜转运过程进行了一些尝试性的研究,但研究结果不能被合理地解释[6]。直到2000年FP1的发现为人们进一步研究该问题提供了一个新的线索和希望。
研究表明,FP1在参与机体铁稳态的组织有广泛的表达,而且在这些组织里起了重要的铁输出作用[7]。比如在十二指肠,FP1定位于十二指肠上皮细胞的基侧膜,负责十二指肠的铁向体循环的输出[8]。在肝脏和脾脏,FP1定位于网状内皮系统细胞的胞浆,并且参与枯否细胞的铁的再循环[9]。然而,在人和啮齿动物的肺部,FP1却定位于呼吸道上皮细胞的顶膜[10]。至于FP1在胎盘的表达,Bradley和Bastin等研究显示位于STB的基侧膜[11, 12]。本次研究只发现STB细胞定位而没有显示明确的基侧膜定位。可能是由于本次研究采用的是灵敏度较低的DAB显色而非免疫荧光定位。另外,也可能是本研究的一抗是抗鼠而非抗人的。但研究至少表明FP1确实定位于STB细胞,至于亚细胞定位可以采用更加精确的方法进一步证实。
研究表明,FP1表达的调节具有组织特异性。在十二指肠,FP1的表达受HEPC的调节。HEPC是机体铁稳态的重要调节因子[13-17], FP1是其发挥作用的重要下游因子。在肝脏和肺脏,FP1显然受铁反应元件(IRE)/ 铁调节蛋白(IRPS)系统的调节[18]。而在PC12细胞,FP1的调节似乎又在转录水平而不受IRE/IRPs介导[19]。另外,研究还显示FP1的表达还可能受发育的调节[2, 20, 21]。在胎盘,FP1表达随孕龄的增加而增加,妊娠晚期(胎盘铁转运最大的时期)表达最高[3]。Martin[22]的研究显示,HEPC转基因胚胎的胎盘铁转运明显降低,但胎盘FP1的mRNA表达并无明显变化,提示胎盘FP1表达可能不受HEPC调节。Gambling[23]等研究发现,在母体贫血时胎盘FP1mRNA表达也无明显变化。本研究也没有发现母体不同铁状态下胎盘FP1的mRNA表达有明显的差别,而且我们也没有发现FP1蛋白表达的明显差异。另外,Bradley [11] 等研究也显示胎盘FP1蛋白的表达与IRPs活性无关。据此,我们推测胎盘FP1表达不受IRE/IRPs系统调节,至少它可能不是主要的调节方式。本研究结果显示胎盘FP1蛋白表达变化的趋势和mRNA变化的趋势并不十分一致,也提示人类胎盘FP1的表达可能有多种调节机制,如转录后和翻译后的调节。虽然本次研究没有同时测定母-胎铁转运量的变化,但既往的研究[23, 24]显示,母亲铁缺乏时胎盘的铁转运能力是增强的,据此我们可以推测,除了FP1外,可能还有其它的因子直接或间接参与胎盘的铁输出。
(致谢:感谢西安交通大学医学院的吕社民教授、郑鹏生教授以及黄辰副教授给予的帮助和指导。)
参考文献:
1. GANZ T, GEFFEN D. Cellular iron: Ferroportin is the only way out[J]. Cell metablism, 2005: 155-157.
2. MCKIE AT, MARCIANI P, ROLFS A, et al. A Novel Duodenal Iron -Regulated Transporter,IREG1,Implicated in the Basolateral Transfer of Iron to the Circulation[J]. Molecular Cell, 2000, 5: 299-309.
3. DONOVAN A, BROWNLLIE A, ZHOU Y, et al. Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter[J]. Nature, 2000, 403: 776-781.
4. VAN DIJK JP, VAN KREEL BK, HEEREN JWA. Studies on the mechanisms involved in iron transfer across the isolated guinea pig placenta by means of bolus experiments [J]. J Dev Physiol, 1985, 7: 1-16.
5. VERRIJT CEH, KROOS MJ, HUIJSKES-HEINS MIE, et al. Accumulation and release of iron in polarly and non-polarly cultured trophoblast cells isolated from human term placentas[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 1999, 86: 73–81.
6. VERRIJT CEH. VECTORIAL aspects of iron transfer in human term placenta[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 1999, 83: 125-126.
7. ABBOUD S, HAILE DJ. A Novel Mammalian Iron-regulated Protein Involved in Intracellular Iron Metabolism[J]. The Journal of Biological Chemistry, 2000, 275: 19906-19912.
8. ZOLLER H, THEURL I, KOCK R, et al. Mechanisms of Iron Mediated Regulation of the Duodenal Iron Transporters Divalent Metal Transporter 1 and Ferroportin 1[J]. Blood Cells, Molecules, and Diseases, 2002, 29: 488-497.
9. GALLI´A, BERGAMASCHI G, RECALDE H, et al. Ferroportin gene silencing induces iron retention and enhances ferritin synthesis in human macrophages[J]. British Journal of Haematology, 2004, 127: 598-603.
10. YANG F, HAILE DJ, WANG X, et al. Apical location of ferroportin 1 in airway epithelia and its role in iron detoxification in the lung[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 289: L14-L23.
11. BRADLEY J, LEIBOLD EA, HARRIS ZL,et al. Influence of gestational age and fetal iron status on IRP activity and iron transporter protein expression in third-trimester human placenta[J]. Am J Physiol Regulatory Integrative Comp Physiol, 2004, 287: 894-901.
12. BASTIN J, DRAKESMITH H, REES M, et al. Localisation of proteins of iron metabolism in the human placenta and liver[J]. British Journal of Haematology, 2006, 134: 532-543.
13. NEMETH E, TUTTLE MS, POWELSON J, et al. Hepcidin Regulates Cellular Iron Efflux by Binding to Ferroportin and Inducing Its Internalization[J]. Science, 2004, 306: 2090-2093.
14. ATANASIU V, MANOLESCU B, STOIAN I. Hepcidin – central regulator of iron metabolism[J]. European Journal of Haematology, 2006, 78: 1-10.
15. DEICHER R, HORL WH. New insights into the regulation of iron homeostasis[J]. European Journal of Clinical Investigation, 2006, 36: 301-309.
16. KOSS L. Hepcidin Decreases Ferroportin 1 Expression in a Mouse Macrophage Cell Line[J]. Journal of Undergraduate Research, 2005, 6.
17. YAMAJI S, SHARP P, RAMESH B, et al. Inhibition of iron transport across human intestinal epithelial cells by hepcidin[J]. Blood, 2004, 104: 2178-2180.
18. LYMBOUSSAKI A, PIGNATTI E, MONTOSI G, et al. The role of the iron responsive element in the control of ferroportin1/IREG1/MTP1 gene expression[J]. Journal of Hepatology, 2003, 39: 710-715.
19. CHEN Y, QIAN ZM, DU J, et al. Iron loading inhibits ferroportin1 expression in PC12 cells[J]. Neurochemistry International, 2005, 47: 507-513.
20. LEONG WI, LONNERDAL B. Iron transporters in rat mammary gland: effects of different stages of lactation and maternal iron status[J]. American Journal of Clinical Nutrition, 2005, 81: 445-453.
21. [21]. LEONG WI, BOWLUS CL, TALLKVIST J, et al. DMT1 and FPN1 expression during infancy: developmental regulation of iron absorption[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 285: 1153-1161.
22. MARTIN ME, NICOLAS G, HETET G, et al. Transferrin receptor 1 mRNA is downregulated in placenta of hepcidin transgenic embryos[J]. FEBS Letters 2004, 574: 187-191.
23. GAMBLING L, DANZEISEN R, GAIR S, et al. Effect of iron deficiency on placental transfer of iron and expression of iron transport proteins in vivo and in vitro[J]. Biochem. J, 2001, 356: 883-889.
24. O’BRIEN KO, ZAVALETA N, ABRAMS SA, et al. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy[J]. Am J Clin Nutr, 2003, 77: 924-930.
收稿日期
中国常用益生菌菌种的耐药性研究
徐进 刘秀梅 杨宝兰 李志刚 姚景会 余冬敏
中国疾病预防控制中心营养与食品安全所,北京 10021
摘要:采用肉汤稀释法,对中国益生菌保健品行业常用的9株双歧杆菌和22株乳杆菌,共计31株益生菌进行了20种抗生素的耐药性检测。结果表明: 31株益生菌均对下列抗生素敏感:氨苄西林、青霉素、亚胺培南、庆大霉素、阿莫西林、阿莫西林/棒酸、加替沙星、红霉、素克林霉素、四环素、利福平和头孢噻肟;而对萘啶酮酸、万古霉素和磷霉素的耐药率较高。
关键词:益生菌 耐药性
Antimicrobial Susceptibility of Probiotics
Xu Jin, Liu Xiumei, Yao Baolan, Li Zhigang, Yao jinghui, Yu Dongmin
National Institute of Nutrition and Food Safety, China Center for Control and Prevention, Beijing 100021, China
Abstract: The aim of our study was to analyse the antibiotic susceptibility of 31 probiotics strains, including 9 Bifidobacterium and 22 Lactobacillus used for the manufacture of various fermented foods in China. Probiotics are tested for minimum inhibitory concentrations(MIC) of 20 kinds of antibiotics by broth dilution method on cation-adjusted Mueller-Hinton broth with lysed horse blood. 31 strains of probiotics were sensitive to ampicillin ,penicillin ,imipenem ,gentamicine, amoxicillin, amoxicillin/clavulanic acid ,gatifloxacin , erythromycin , clindamycin, and resistant to nalidixic acid, vancomycine , fosfomycin.
Key words: Probiotics, Antibiotic Susceptibility Testing
2002年FAO/WHO(Food and Agriculture Organization/World Health Organization)联合专家组提出了《用于食品的益生菌安全性评价指导原则》,原则指出益生菌是指活的微生物,当人体摄入足够量的时候可对人体产生有益的作用。通常所说的益生菌主要就是指乳杆菌和双歧杆菌等乳酸菌,这些益生菌广泛应用于发酵食品中,如酸奶、乳酪,或者将益生菌直接制成菌粉食用。
传统的益生菌菌种,比如嗜热链球菌和保加利亚乳杆菌在安全应用上已有很长的历史,被认为是没有致病可能性的共生微生物体。但目前新的益生菌菌种不断被开发出来进入市场,这些新菌种能否分享传统菌种的安全性,目前引起国外专家的极大争论。鉴于此,FAO/WHO在《用于食品的益生菌安全性评价指导原则》中指出益生菌存在的可能危害包括:①益生菌进入血液引起的人体全身性感染(菌血症和感染性心内膜炎);②益生菌产生有害的代谢活性产物对人体产生的不良反应;③食用益生菌制剂后对敏感个体的免疫刺激作用;④益生菌菌种在长期使用后所携带耐药基因的转移。由益生菌引起的菌血症,产生的有害代谢活性产物和个体免疫刺激作用发生率非常低,而某些益生菌对抗生素具有天然的耐药性,所以目前益生菌的安全性问题主要集中在由益生菌所携带耐药基因转移引起的耐药性问题,益生菌菌株的耐药性评价时目前国际上益生菌安全评价的首要内容。本文采用肉汤稀释法,对2005~2006年在中国保健品市场常用的22株乳杆菌和9株双歧杆菌的耐药性进行了分析,初步评估中国目前所使用的益生菌的耐药状况,为中国益生菌的安全性评估提供技术依据。
1 材料与方法:
1.1材料:益生菌为中国保健食品行业常用菌种,包括9株双歧杆菌(Bifidobacterium)和22株乳杆菌(Lactobacillus)。
1.2益生菌菌种药物敏感性试验
采用美国Clinical and Laboratory Standards Institute(CLSI)推荐的96微孔肉汤稀释法,培养基为金属离子调整的MH培养基(Mueller-Hinton Agar)加裂解的马血(2.5~5% v/v)[1]。96微孔耐药板及抗生素浓度的制备由天津金章公司提供。质控菌株为CLSI推荐的Streptococcus pneumoniae ATCC49619。使用的抗生素(OXOID,英国)种类及浓度范围见表1。
表1 本实验使用的抗生素及其浓度范围
Table 1 Antibiotics used in this study
|
序号 |
抗生素名称 |
中文 |
浓度(μg/ml) |
|
1 |
Ampicillin |
氨苄西林 |
0.016-256 |
|
2 |
Penicillin |
青霉素 |
0.016-256 |
|
3 |
Imipenem |
亚胺培南 |
0.016-256 |
|
4 |
Gentamicine |
庆大霉素 |
0.016-256 |
|
5 |
Vancomycine |
万古霉素 |
0.016-256 |
|
6 |
Erythromycin |
红霉素 |
0.016-256 |
|
7 |
Clindamycin |
克林霉素 |
0.016-256 |
|
8 |
Trimethoprin/sulfamethoxazone |
甲氧苄胺嘧啶/磺胺甲基异噁唑 |
0.002-32 |
|
9 |
Amoxicillin |
阿莫西林 |
0.016-256 |
|
10 |
Amoxicillin/clavulanic acid |
阿莫西林/棒酸 |
0.016-256 |
|
11 |
Gatifloxacin |
加替沙星 |
0.016-256 |
|
12 |
Ciprofloxacin |
环丙沙星 |
0.002-32 |
|
13 |
Chloramphenicol |
氯霉素 |
0.016-256 |
|
14 |
Streptomyxine |
链霉素 |
0.016-256 |
|
15 |
Tetracycline |
四环素 |
0.016-256 |
|
16 |
Fosfomycin |
磷霉素 |
0.016-256 |
|
17 |
Kanamycine |
卡那霉素 |
0.016-256 |
|
18 |
Nalidixic acid |
萘啶酮酸 |
0.016-256 |
|
19 |
Ceftriaxone |
头孢曲松 |
0.016-256 |
|
20 |
Cephalothin |
头孢噻吩 |
0.016-256 |
|
21 |
Cefepime |
头孢吡肟 |
0.016-256 |
|
22 |
Norfloxacine |
诺氟沙星 |
0.016-256 |
|
23 |
Rifampin |
利福平 |
0.016-256 |
|
24 |
Cefotaxime |
头孢噻肟 |
0.016-256 |
2、药物敏感性试验结果:
本试验益生菌菌种对不同抗生素的最低抑菌浓度(Minimum inhibitory concentrations , MIC)范围见表2。
表2 益生菌菌种对不同抗生素的最低抑菌浓度(MIC)范围(μg/ml)
Table 2 Minimum inhibitory concentrations of Probiotics to different antibiotics
|
抗生素 |
耐药判定标准的MIC值 |
乳杆菌(22株) |
|
双歧杆菌 (9株) | ||
|
MIC范围 |
敏感率(%) |
|
MIC范围 |
敏感率(%) | ||
|
氨苄西林 |
≥8 (3) |
0.016-1 |
100.00 |
|
0.016-4 |
100.00 |
|
青霉素 |
≥8 (3) |
0.016-4 |
100.00 |
|
0.016-4 |
100.00 |
|
亚胺培南 |
≥0.5 (3) |
0.016-0.25 |
100.00 |
|
0.016-0.25 |
100.00 |
|
庆大霉素 |
≥16 (3) |
0.016-2 |
100.00 |
|
0.016-4 |
100.00 |
|
阿莫西林 |
≥8(2) |
0.016-4 |
100.00 |
|
0.016-4 |
100.00 |
|
阿莫西林/棒酸 |
≥8 (2) |
0.016-4 |
100.00 |
|
0.016-0.5 |
100.00 |
|
加替沙星 |
≥4 (2) |
0.016-1 |
100.00 |
|
0.016-4 |
100.00 |
|
红霉素 |
≥8(3) |
0.016-0.25 |
100.00 |
|
0.5-0.016 |
100.00 |
|
克林霉素 |
≥8 (2) |
0.016-0.5 |
100.00 |
|
0.016-4 |
100.00 |
|
四环素 |
≥8 (2) |
0.016-4 |
100.00 |
|
0.016-16 |
100.00 |
|
利福平 |
≥4 (2) |
0.016-2 |
100.00 |
|
0.016-2 |
100.00 |
|
头孢噻肟 |
≥32 (2) |
0.016-8 |
100.00 |
|
0.125-4 |
100.00 |
|
链霉素 |
≥16 (2) |
0.016-16 |
95.45 |
|
0.016-8 |
100.00 |
|
头孢噻吩 |
≥32 (1) |
0.125-64 |
90.91 |
|
0.125-64 |
77.78 |
|
氯霉素 |
≥4 (2) |
0.012-4 |
90.91 |
|
0.016-4 |
100.00 |
|
环丙沙星 |
≥4(1) |
0.016-8 |
81.82 |
|
0.016-16 |
100.00 |
|
诺氟沙星 |
≥16 (2) |
0.125-128 |
77.27 |
|
2-64 |
66.67 |
|
甲氧苄胺嘧啶/磺胺甲基异噁唑 |
≥4 (2) |
0.016-32 |
72.27 |
|
0.016-32 |
66.67 |
|
卡那霉素 |
≥16 (2) |
0.5-64 |
68.18 |
|
0.0312-64 |
88.89 |
|
头孢曲松 |
≥32 (1) |
0.0625-32 |
63.64 |
|
0.0312-16 |
100.00 |
|
头孢吡肟 |
≥32 (1) |
0.0312-128 |
54.55 |
|
0.016-32 |
100.00 |
|
磷霉素 |
≥32 (1) |
0.125-256 |
31.82 |
|
0.016-256 |
66.67 |
|
万古霉素 |
≥32 (3) |
0.25-256 |
27.27 |
|
0.016-256 |
66.67 |
|
萘啶酮酸 |
≥32(1) |
128-256 |
0.00 |
|
1-256 |
33.33 |
注:(1)Scientific committee on animal nutrition (SCAN) [9];
(2)本试验判定标准[2,3];
(3)CLSI[1] ;
由表2可见,22株乳杆菌和9株双歧杆菌有相似的耐药谱,乳杆菌对本实验所选用的抗生素的耐药性要高于双歧杆菌。22株乳杆菌和9株双歧杆菌均对下列抗生素敏感:氨苄西林、青霉素、亚胺培南、庆大霉素、阿莫西林、阿莫西林/棒酸、加替沙星、红霉、素克林霉素、四环素、利福平和头孢噻肟。22株乳杆菌对萘啶酮酸、万古霉素和磷霉素的耐药性较高,分别为100%,72.63%和68.18%。
3、讨论
益生菌安全性一个非常重要的方面是其耐药性。本研究结果显示,22株乳杆菌和9株双歧杆菌有相似的耐药谱。在2005年检测的中国常用发酵乳制品的12株益生菌中,耐药的主要模式为丁胺卡那霉素-卡那霉素-萘啶酮酸-复方新诺明-甲氧苄胺嘧啶-万古霉素[4],和本次实验的结果相似。从国内外资料来看,益生菌均耐受多种抗生素。Katla 等对挪威市场的189株乳酸菌的耐药检测结果表明[5]:189株乳酸菌均对下列抗生素敏感:氨苄西林、青霉素G、头孢噻吩、万古霉素、杆菌肽、庆大霉素、链霉素、红霉素、四环素、氯霉素和环丙沙星。Temmerman等对欧洲益生菌产品市场分离到的187株益生菌的耐药检测表明[6]:对卡那霉素,万古霉素、四环素、青霉素G、红霉素和氯霉素的耐药率分别为79%、65%、26%、23%、16%和11%,68.4%的菌株具有多重耐药特性。Lim等对韩国市场37株双歧杆菌的耐药检测结果表明[7]:大部分双歧杆菌耐受头孢噻吩、卡那霉素、新霉素、萘啶酮酸和多黏菌素B,部分双歧杆菌耐受庆大霉素和链霉素。Masco等对比利时市场100株乳酸菌的耐药检测结果表明[8]:所有菌株均对阿莫西林、氯霉素、红霉素和万古霉素敏感;其中11株双歧杆菌均耐受庆大霉素和多年菌素B。综合国内与国际资料来看,无论是乳杆菌还是双歧杆菌,萘啶酮酸和卡那霉素的耐药率较高,其他抗生素的结果则有很大差异,不同的益生菌菌种显示了各自复杂的耐药特性。这主要是因为,2007年CLSI才出版了乳酸菌耐药试验的标准[1],在此之前由于各实验室所采用的培养基,使用的抗生素,检测的方法和质控菌株不同,使得不同试验室间的数据也不同。本研究所采用的方法为2007年CLSI出版的乳酸菌耐药试验的标准。
对益生菌耐药性的管理上不同国家及国际组织也不尽相同。美国FDA对益生菌的耐药性没有特别规定,把益生菌类发酵食品作为GRAS (generally recognized as safe)级来看待,需要明确的是美国FDA并不是将益生菌菌株本身做为GRAS 来看待,而是指益生菌发酵的食品。益生菌及其制品在欧洲使用历史悠久并销量巨大,因此欧盟食品安全局提出了Qualified Perception of Safety(QPS)概念[9]。其内涵是既不等同于有长期使用历史的益生菌就是安全的观点,也不能将益生菌的安全性评价规定的过于严格而阻碍益生菌的市场发展,就益生菌的耐药性而言,规定益生菌不得携带可转移的耐药基因。中国的益生菌评审机构目前尚未对益生菌耐药性作出明确的规定。从欧盟食品安全局对益生菌安全性的管理来看,如何评价益生菌的耐药特性对人群健康的影响将是对益生菌进行危险性评估最重要的内容之一。
5 参考文献
1. JAMES H,Janet HINDER, et al. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or Fastidious Bacreria[M] .Clinical and laboratory standards institute..2007,26(19):24-25.
2. ANJA S. Hummel, Christian Hertel, et al. Antibiotic resistances of starter and probiotic strains of Lactic acid bacteria[J]. Applied and Environment Microbiology, 2007, 73(3):730-739.
3. MOUBARECK C, GAVINI F, et al. Antimicrobial susceptibility of bifidobacteria[J]. Journal of Antimicrobial Chemotherapy, 2005(1)38-44.
4. 徐进,刘秀梅. 国内保健食品常用益生菌株的耐药性分析[J]. 中国食品卫生杂志, 2005,17(2):108-112.
5. KATLA AK, KRUSE H, et al. Antimicrobial susceptibility of starter culture bacteria used in Norwegian dairy products[J]. International Journal of Food Microbiology, 2001;67(1-2):147-52.
6. TEMMERMAN R, SWINGS J, et al. Identification and antibiotic susceptibility of bacterial isolates from probiotic products[J]. International Journal of FoodMicrobiology, 2003; 81(1):1-10.
7. LIM K S , HUH S C, et al. Antimicrobial Susceptibility of Bifidobacteria[J]. Journal Dairy Science, 1993,76:2168-2174.
8. MASCO L, HOORDe K Van, et al. Antimicrobial susceptibility of Bifidobacterium strains from humans, animals and probiotic products [J]. Journal of Antimicrobial Chemotherapy, 2005:185-94.
9. European food safety authority. Scientific committee on animal nutrition on the criteria for assessing the micro-organisms resistant to antibiotics of human clinical and veterinary importance. revised on 24 January 2003.
调查研究
中国5岁以下儿童营养不良现状及其变化趋势的研究
刘爱东 赵丽云 于冬梅 于文涛 贾凤梅 张继国 翟凤英
中国疾病预防控制中心营养与食品安全所,北京 100050
摘要:目的 分析我国5岁以下儿童的营养不良状况及变化趋势,为制定儿童营养政策提供依据。方法 采用多阶段分层整群随机抽样的方法,按照东、中、西三类地区和城市、农村的分层原则,在全国选取17607名5岁以下儿童,测量儿童的身高(长)和体重。结果 2006年中国5岁以下儿童生长迟缓率为9.9%,低体重率为5.9%,消瘦率为2.2%;儿童生长迟缓率农村是城市的5.3倍,低体重率农村是城市的4.6倍,差异显著(P<0.05);中、西部地区儿童营养不良率显著高于东部地区(P<0.05);与2002年相比,2006年儿童生长迟缓率下降了30.8%,儿童低体重率下降了24.4%。结论 近几年来,中国5岁以下儿童营养不良率逐年下降,下降速度城市高于农村。西部地区农村儿童营养不良问题仍有待改善,同时中部地区农村儿童的营养不良状况也应得到充分关注。
关键词 5岁以下儿童 营养不良 变化趋势
Study on malnutrition status and changing trend of Chinese children less than 5 years
Liu Ai-dong, Zhao Li-yun, Yu Dong-mei, Yu Wen-tao, Jia Feng-mei, Zhang ji-guo,Zhai Feng-ying
National Institute for Nutrition and Food Safety, Chinese Center for Disease Control and Prevention, Bejing 100050, China
Abstract: Objective To analysis the malnutrition status and changing trend of the children less than five years in China, and to afford the reference information for the establishment of children nutrition related policies. Methods According to the classification of east, middle and west areas in China, as well as urban and rural, the multi-stage cluster probability sampling was used to select randomly total 17607 children under 5 years, whose weight and height were measured in standard method. Outcome The stunting prevalence of Chinese children under 5 years is 9.9%, the underweight prevalence is 5.9% and the wasting prevalence is 2.2%. There is significant difference of the malnutrition prevalence between the urban areas and rural areas (p<0.05). The prevalence of stunting of rural children is 5.3 times higher than that of urban as well as the prevalence of underweight in rural is 4.6 times higher
基金项目:卫生部妇社司“妇女和儿童发展纲要指标调查”项目
作者简介:刘爱东,男,硕士,助理研究员
than that in urban. In the same way, the prevalence of malnutrition in middle and west areas is significantly higher than the prevalence in east area (p<0.05). Compared with the data of Chinese Nutrition and Health Survey (CNHS) in 2002, the prevalence of children stunting and underweight decreased by 30.8% and 24.4% respectively in 2006. Conclusion In recent years, the malnutrition prevalence of Chinese children under 5 years declined yearly and the prevalence of malnutrition in urban decreased faster than that in rural. The nutrition status of the children in west areas needs more improvement and at the same time, the status of children nutrition of west area also requires more concerns.
Key word: children under 5 years malnutrition changing trend
<5岁儿童营养不良会对其一生的健康产生不良影响,不仅会造成儿童当前身体和智力的发育迟缓,同时还会增加成年时期患肥胖、高血压、糖尿病等慢性疾病的危险。本文利用2006年卫生部在全国范围开展的“中国儿童发展纲要(2001-2010)”和“中国妇女发展纲要(2001-2010)”(以下简称“两纲”)评估指标调查数据,对中国<5岁儿童营养不良状况及近年来变化趋势进行分析,及时了解5岁以下儿童的营养不良状况及变化趋势,为国家制定下一步相应的政策提供依据。
1 研究对象和方法
1.1对象 利用国家发改委提出的将全国31个省、自治区、直辖市分成东、中、西地区的方法,同时将各类地区分为城市和农村两层,采用多阶段随机整群抽样方法,在全国14个省、自治区和直辖市中随机抽取43个市、县作为调查点,在每个市、县中再按照分层随机方法分别抽取370个和350个5岁以下儿童,各年龄组人数保持均衡。
1.2 研究方法 儿童的营养状况评价采用Z评分法,以1978年WHO/NCHS推荐的性别年龄别身高体重参考值作为评价儿童营养不良的评价标准。低于标准年龄别身高、年龄别体重、身高别体重2个标准差为中、重度营养不良。根据2002年中国居民营养与健康调查(CNHS2002)以及2005年全国营养监测系统(CFNSS2005)数据结果比较分析变化趋势。采用SAS8.2统计软件进行统计。
2 结果
2.1基本情况
本研究共调查了5岁以下儿童17607人,各年龄组儿童人数比例基本均衡。城市儿童6541人(占37.2%),农村儿童11066人(占62.8%);男孩9478人(占53.8%),女孩8129人(占46.2%);按三大经济地带划分,东部地区共调查5241人、中部地区4725人,西部地区7641人,各占29.8%、26.8%和43.4%。
2.2 全国5岁以下儿童中、重度营养不良率
2006年中国5岁以下儿童生长迟缓率为9.9%,低体重率为5.9%,消瘦率为2.2%。低体重率男孩为6.1%,女孩为5.8%;生长迟缓率男孩为10.5%,女孩为9.4%,营养不良率无性别差异(P>0.05)。
2.2.1 城乡之间差异 全国城市和农村5岁以下儿童营养不良率存在显著性差异(P<0.01)。儿童生长迟缓率农村(11.7%)是城市(2.2%)的5.3倍,儿童低体重率农村(6.9%)为城市(1.5%)的4.6倍。其中西部农村地区儿童生长迟缓率和低体重率最高,分别达15.5%和8.6%。
2.2.2 地区之间差异 从东、中、西三大地区来看,5岁以下儿童营养不良率差异显著(P<0.05)(见表1、表2)。东部地区最低,生长迟缓率4.9%、低体重率3.5%;西部地区最高,生长迟缓率和低体重率分别为13.9%和7.8%;中部地区儿童营养不良状况更接近于西部地区,生长迟缓率和低体重率分别为11.8%和7.0%。城乡差异在三类地区中也同样存在,但西部地区的城乡差距最大,而东部地区城乡之间差距最小。
2.2.3 月龄之间差异 由表1、表2可见,全国1岁以内婴儿生长迟缓率最低为6.1%,12~23个月龄时,开始上升至12.9%,随后稍有下降后又开始上升,至48~59个月龄时达到最高13.1%;低体重率的变化趋势和生长迟缓率相似,1岁以内、12~23月龄,48~59月龄分别为2.4%、7.3%和7.4%。
表1 全国5岁以下儿童生长迟缓率
Table 1 The stunting prevalence of Chinese children under five years (%)
|
月龄 |
东部地区 |
|
中部地区 |
|
西部地区 |
|
全国 | ||||||||
|
城市 |
农村 |
合计 |
城市 |
农村 |
合计 |
城市 |
农村 |
合计 |
城市 |
农村 |
合计 | ||||
|
0~ |
2.3 |
1.8 |
1.9 |
|
1.4 |
8.9 |
7.6 |
|
2.0 |
10.0 |
9.0 |
|
2.0 |
7.1 |
6.1 |
|
12~ |
2.3 |
7.5 |
6.1 |
|
1.8 |
16.6 |
15.0 |
|
3.1 |
20.2 |
18.1 |
|
2.3 |
15.0 |
12.9 |
|
24~ |
2.0 |
4.0 |
3.5 |
|
4.3 |
10.3 |
9.9 |
|
1.7 |
12.2 |
10.9 |
|
2.6 |
9.0 |
7.9 |
|
36~ |
0.2 |
6.8 |
5.1 |
|
2.9 |
12.8 |
11.8 |
|
2.4 |
15.7 |
14.1 |
|
1.5 |
12.0 |
10.2 |
|
48~ |
1.4 |
9.9 |
7.7 |
|
4.0 |
16.3 |
15.2 |
|
3.2 |
19.1 |
17.1 |
|
2.6 |
15.3 |
13.1 |
|
小计 |
1.6 |
6.0 |
4.9 |
|
2.9 |
12.9 |
11.8 |
|
2.5 |
15.5 |
13.9 |
|
2.2 |
| |
